Hằng số cân bằng của phản ứng N2O4g ⇌ 2NO2g ở 2 °C là
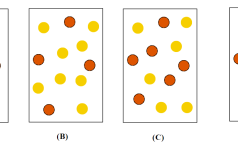
Câu hỏi
Nhận biết Hằng số cân bằng của phản ứng N2O4(g) ⇌ 2NO2(g) ở 2 °C là KC = 2,0. Nếu mỗi quả cầu màu vàng () đại diện cho 1 mol N2O4 và mỗi quả cầu màu nâu là 1 mol NO2 (
) thì bình chứa 1,0 L nào sau đây đại diện cho hỗn hợp cân bằng ở 2 °C?
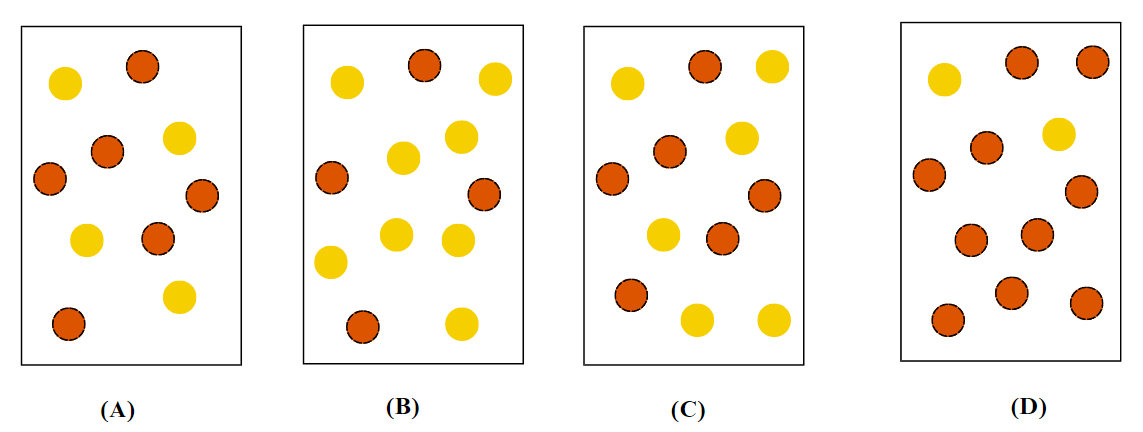
Đáp án đúng: B
Lời giải của Tự Học 365
Dựa vào lý thuyết về cân bằng hoá học.
Giải chi tiết:
Giả sử ban đầu hỗn hợp có nồng độ N2O4 là 1 M. Ta có:
N2O4(g) ⇌ 2NO2(g)
Ban đầu: 1 M
P/ư x M 2x M
CB 1 - x 2x
Ta có: \({K_C} = \dfrac{{{{[N{O_2}]}^2}}}{{[{N_2}{O_4}]}} = \dfrac{{{{(2x)}^2}}}{{(1 - x)}} = 2 = > x = 0,5\).
Vậy tại thời điểm cân bằng nồng độ của N2O4 là 0,5 M, của NO2 là 1 M. Vậy hỗn hợp tại thời điểm cân bằng số phân tử NO2 luôn gấp đôi N2O4 ⟹ Hình B thỏa mãn.
Luyện tập
Câu hỏi liên quan
-

Pha Ngừm đã thành lập nước Lan Xang vào năm nào?
-

Kinh đô của nước ta dưới thời Ngô là
-

Công trình kiến trúc tiêu biểu của vương quốc Cam-pu-chia thời phong kiến là
-

Người chỉ huy đoàn tham hiểm lần đầu tiên đi vòng quanh trái đất bằng đường biển là
-

Công trình kiến trúc tiêu biểu của vương quốc Lào thời phong kiến là
-

Người Cam-pu-chia đã sáng tạo ra chữ viết vào thời gian nào?
-

Quê hương của phong trào văn hóa Phục hưng là
-

Quốc hiệu của nước ta dưới thời Đinh – Tiền Lê là
-

Em hãy trình bày sự hình thành và phát triển của các vương quốc phong kiến Đông Nam Á từ nửa sau thế kỷ X đến đầu thế kỷ XVI?
-

Bằng kiến thức đã học về cuộc kháng chiến chống quân xâm lược Tống (1075 - 1077), em hãy:
a. Chỉ ra những nét độc đáo trong cách đánh giặc của Lý Thường Kiệt?
b. Đánh giá vai trò của Lý Thường Kiệt trong cuộc kháng chiến?
