Cho 1328 gam hỗn hợp Fe và kim loại M tác dụng với dun

Câu hỏi
Nhận biếtCho 13,28 gam hỗn hợp Fe và kim loại M tác dụng với dung dịch HNO3 dư, thu được dung dịch X (không chứa muối amoni) và 0,27 mol hỗn hợp B (gồm NO và NO2) có tỉ khối so với H2 bằng 19. Cô cạn X thu được m gam hỗn hợp muối Y. Nung Y đến khối lượng không đổi thu được chất rắn Z và hỗn hợp E gồm khí và hơi. Cho toàn bộ E vào 500 gam nước, không có khí thoát ra và dung dịch thu được chỉ chứa một chất tan, có nồng độ 6,165%. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án đúng: C
Lời giải của Tự Học 365
Giải chi tiết:
Sơ đồ phản ứng:
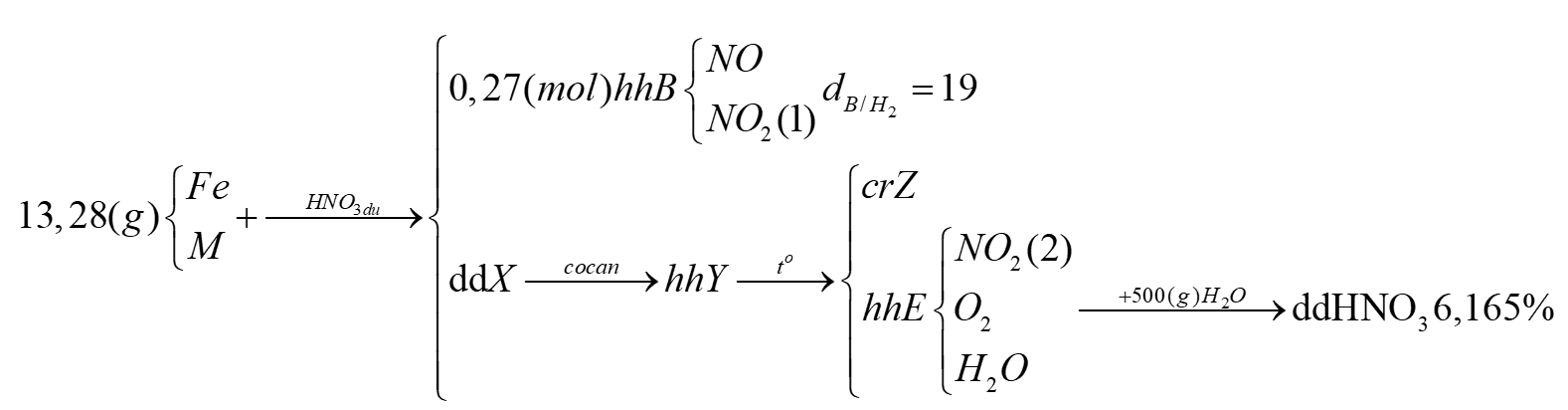
Đặt: nFe = a (mol), nM = b (mol), hóa trị của M là n
MB = 19.2 = 38 (đvC)
⟹\(\dfrac{{{n_{NO}}}}{{{n_{N{O_2}}}}} = \dfrac{{46 - 38}}{{38 - 30}} = \dfrac{1}{1} = \dfrac{{0,135(mol)}}{{0,135(mol)}}\)
Hỗn hợp E (khí và hơi) ⟶ dung dịch chỉ chứa 1 chất tan là HNO3.
nHNO3 = nNO3(muối) = 0,135.3 + 0,135.1 = 0,54 (mol)
⟹ mdd = (0,54.63)/6,165% = 551,82 (g)
nNO2(2) = nHNO3 = 0,54 (mol)
Bảo toàn electron: 4nO2 = nNO2(2) ⟹ nO2 = 0,135 (mol)
Mà mdd = mH2O + mO2 + mNO2 + mH2O(muối)
⟹ 551,82 = 500 + 0,135.32 + 0,54.46 + mH2O(muối)
⟹ mH2O(muối) = 22,66 (g)
mmuối = mKL + mNO3(muối) + mH2O(muối) = 13,28 + 0,54.62 + 22,66 = 69,42 (g)
Luyện tập
Câu hỏi liên quan
-

Công trình kiến trúc tiêu biểu của vương quốc Lào thời phong kiến là
-

Bằng kiến thức đã học về cuộc kháng chiến chống quân xâm lược Tống (1075 - 1077), em hãy:
a. Chỉ ra những nét độc đáo trong cách đánh giặc của Lý Thường Kiệt?
b. Đánh giá vai trò của Lý Thường Kiệt trong cuộc kháng chiến?
-

Người Cam-pu-chia đã sáng tạo ra chữ viết vào thời gian nào?
-

Em hãy trình bày sự hình thành và phát triển của các vương quốc phong kiến Đông Nam Á từ nửa sau thế kỷ X đến đầu thế kỷ XVI?
-

Kinh đô của nước ta dưới thời Ngô là
-

Pha Ngừm đã thành lập nước Lan Xang vào năm nào?
-

Quốc hiệu của nước ta dưới thời Đinh – Tiền Lê là
-

Công trình kiến trúc tiêu biểu của vương quốc Cam-pu-chia thời phong kiến là
-

Quê hương của phong trào văn hóa Phục hưng là
-

Người chỉ huy đoàn tham hiểm lần đầu tiên đi vòng quanh trái đất bằng đường biển là
