Tiến hành các thí nghiệm sau: (1) Cho vật bằng gang vào dung dịch HCl

Câu hỏi
Nhận biếtTiến hành các thí nghiệm sau:
(1) Cho vật bằng gang vào dung dịch HCl.
(2) Cho đinh sắt vào dung dịch H2SO4 2M.
(3) Nhúng thanh Zn vào dung dịch AgNO3.
(4) Để miếng tôn (Fe tráng Zn) có vết xước sâu ngoài không khí ẩm.
(5) Cho Mg vào dung dịch FeCl3 dư.
Số thí nghiệm có xảy ra quá trình ăn mòn điện hóa là
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
(1) Cho vật bằng gang vào dung dịch HCl.
→ Có ăn mòn điện hóa do cặp điện cực Fe-C nhúng trong dd điện li là HCl
(2) Cho đinh sắt vào dung dịch H2SO4 2M.
→ Không ăn mòn điện hóa do không có cặp điện cực
(3) Nhúng thanh Zn vào dung dịch AgNO3.
→ Có ăn mòn điện hóa do cặp điện cực Zn-Ag nhúng trong dd điện li {AgNO3, Zn(NO3)2}
(4) Để miếng tôn (Fe tráng Zn) có vết xước sâu ngoài không khí ẩm.
→ Có ăn mòn điện hóa do cặp điện cực Zn-Fe nhúng trong dd điện li là không khí ẩm
(5) Cho Mg vào dung dịch FeCl3 dư.
→ Không có ăn mòn điện hóa vì chỉ xảy ra phản ứng: Mg + 2FeCl3 → MgCl2 + 2FeCl2.
Do FeCl3 dư nên không có phản ứng Mg và FeCl2 nên không tạo được cặp điện cực Mg-Fe.
Vậy có 3 thí nghiệm xảy ra ăn mòn điện hóa.
Đáp án D
Luyện tập
Câu hỏi liên quan
-



Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?




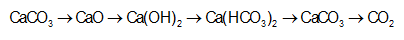

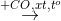 X
X 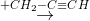 Z
Z 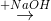 T
T  propan-2-ol.
propan-2-ol.