Hỗn hợp A gồm hai hiđrocacbon mạch hở: CnH2n (n ≥ 2) và CmH2m-2 (m ≥ 2

Câu hỏi
Nhận biếtHỗn hợp A gồm hai hiđrocacbon mạch hở: CnH2n (n ≥ 2) và CmH2m-2 (m ≥ 2). Biết tỉ lệ số mol của CnH2n và CmH2m-2 là 2:3. Nếu đem đốt cháy hoàn toàn một lượng hỗn hợp A rồi hấp thụ toàn bộ sản phẩm cháy bằng nước vôi trong, thu được 50 gam kết tủa và một dung dịch có khối lượng giảm 9,12 gam so với dung dịch nước vôi trong ban đầu và khi thêm vào dung dịch này một lượng dung dịch NaOH dư lại thu được thêm 10 gam kết tủa nữa. Công thức phân tử của hai hiđrocacbon trong hỗn hợp A là:
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
Gọi a, b lần lượt là số mol của CnH2n và CmH2m-2.
Khi đó ta có: \(\frac{a}{b} = \frac{2}{3}\) → 3a – 2b = 0 (3’)
Phương trình hóa học xảy ra khi đốt cháy hỗn hợp A:
CnH2n + \(\frac{{3n}}{2}\) O2 → nCO2 + nH2O (1)
mol a na na
CmH2m-2 + \(\frac{{3m - 1}}{2}\) O2 → mCO2 + (m-1)H2O (2)
mol b bm (m-1)b
Số mol CaCO3 ở phản ứng (3) là : nCaCO3 = 50 : 100 = 0,5 mol
Số mol CaCO3 ở phản ứng (5) là : nCaCO3 = 100 : 100 = 0,1 mol
CO2 + Ca(OH)2 → CaCO3 + H2O (3)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (4)
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O (5)
Từ phản ứng (3) ta có: nCO2 = nCaCO3 = 0,5 (mol)
Từ phản ứng (4) và (5) ta có: nCO2 = 2nCaCO3 = 0,2 (mol)
Tổng số mol của khí CO2 là : 0,5 + 0,2 = 0,7 (mol)
Theo bài ra ta có :
Độ giảm khối lượng của dung dịch = mCaCO3 ở pu (3) – (mCO2 + mH2O)
→ 9,12 = 50 – (0,7.44 + 18.nH2O) → nH2O = 0,56 (mol)
Theo phản ứng (1), (2) ta có:
nCO2 = an + bm = 0,7 (4’)
nH2O = an + b(m – 1) = 0,56 (5’)
Từ (3’), (4’), (5’) ta có : b = 0,14; a = \(\frac{7}{{75}}\) → 2n + 3m = 15
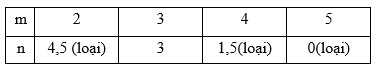
Vậy công thức phân tử của hai hiđrocacbon là : C3H6 và C3H4
Công thức cấu tạo C3H6 là : CH2=CH–CH3
Công thức cấu tạo C3H4 là : CHºC–CH3 hoặc CH2=C=CH2
Đáp án D
Luyện tập
Câu hỏi liên quan
-



Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?







 X
X  Z
Z  T
T  propan-2-ol.
propan-2-ol.