Đốt cháy hoàn đếnàn một rượu (ancol) X thu được CO2 và H2O có tỉ lệ số mol tương ứng là 3 : 4. Thể t

Câu hỏi
Nhận biếtĐốt cháy hoàn toàn một rượu (ancol) X thu được CO2 và H2O có tỉ lệ số mol tương ứng là 3 : 4. Thể tích khí CO2 thu được khi đốt cháy X bằng 0,75 lần thể tích oxi cần dùng để đốt (ở cùng điều kiện). Công thức phân tử của X là
Đáp án đúng: A
Lời giải của Tự Học 365
Giải chi tiết:
+) X + O2 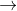 CO2 + H2O
CO2 + H2O
+) Theo định luật bảo toàn nguyên tử N
=> 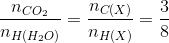
mà nH (X) ≤ 2nC (X) + 2
=> nC(X) = 3 và nH(X) = 8
=> X có dạng C3H8On (n ∈ N*)
+) Do cùng điều kiện nên tỉ lệ thể tích bằng tỉ lệ n => Giả sử đốt 1 mol X
=> 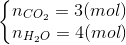 =>
=> 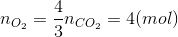
=> Bảo toàn oxi => nO(X) = nO(CO2) + nO(H2O) - nO(O2)
= 2.3 + 4 - 4.2 = 2 (mol)
=> Trong 1 mol X có 2 mol oxi
=> CTPT X là C3H8O2
=> Đáp án A
Luyện tập
Câu hỏi liên quan
-

Cho sơ đồ phản ứng:
H2
 X
X  Y
Y  Z
Z  T
T  propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là






Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?


