Điện phân với điện cực trơ dung dịch chứa 02 mol Cu(NO3)2 cường độ dòng điện 268A trong thời gian t

Câu hỏi
Nhận biếtĐiện phân với điện cực trơ dung dịch chứa 0,2 mol Cu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị của t là
Đáp án đúng: B
Lời giải của Tự Học 365
Giải chi tiết:
Xét quá trình điện phân: Anot(+): 2H2O → 4H+ + O2 + 4e
2x 2x
Catot(-): Cu2+ + 2e → Cu
x 2x
X có 2x mol H+ ; 0,2 - x mol Cu2+ ; 0,4 mol NO3- . Cho Fe vào ta có
Giả sử Fe còn dư nên sản phẩn tạo Fe2+ và H+ hết.
Bảo toàn e 2nFe = 2nCu2+ + 0,75nH+ =2(0,2-x) + 0,75.2x
=> nFe= 0,2-0,25x
=> m rắn = mCu + mFe dư
=> 13,5 =64.(0,2 - x)+14,4 -56.(0,2 - 0,25x) => x =0,05(mol)
=> 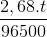 = 0,02.2 => t=3600s=1h
= 0,02.2 => t=3600s=1h
=> Đáp án B
Luyện tập
Câu hỏi liên quan
-

Cho sơ đồ phản ứng:
H2
 X
X  Y
Y  Z
Z  T
T  propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là









