Điện phân 400 ml dung dịch 2 muối KCl và CuCl2 với điện cực trơ và màng ngăn cho đến khi ở anot thoá

Câu hỏi
Nhận biếtĐiện phân 400 ml dung dịch 2 muối KCl và CuCl2 với điện cực trơ và màng ngăn cho đến khi ở anot thoát ra 3,36 lít khí (đktc) thì ngừng điện phân. Để trung hòa dung dịch sau điện phân cần 100 ml dung dịch HNO3 0,6M. Dung dịch sau trung hòa tác dụng với AgNO3 dư sinh ra 2,87 gam kết tủa trắng. Nồng độ mol của mỗi muối trong dung dịch trước điện phân là:
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
Ta có: n khí ở anot = 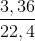 = 0,15 mol
= 0,15 mol
nAgCl = 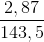 = 0,02 mol
= 0,02 mol
nHNO3 = 0,6.0,1 = 0,06 mol
Đặt nKCl : x mol và nCuCl2 = y mol
=> Cu2+ : y mol Cl- : x + 2y mol
Dung dịch sau điện phân phải trung hòa bằng dung dịch HNO3, chứng tỏ ở catot ion Cu2+ đã điện phân hết và H2O đã bị điện phân.
Cu2+ + 2e 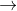 Cu
Cu
y 2y
2H2O + 2e 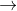 H2 + 2OH-
H2 + 2OH-
0,06 0,06
Phản ứng trung hòa: H+ + OH- 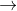 H2O
H2O
0,06 0,06
Dung dịch sau khi trung hòa tác dụng hết với AgNO3 sinh ra kết tủa trắng, chứng tỏ ở anot ion Cl- chưa bị điện phân hết. Vậy khí thoát ra ở anot là Cl2
2Cl- - 2e 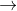 Cl2
Cl2
0,3 0,3 0,15
Cl- + Ag+ 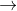 AgCl
AgCl
0,02 0,02
=> nCl- ban đầu = 0,3 + 0,02 = 0,32 mol
Hay x + 2y = 0,32 (1)
Dựa vào bán phản ứng ở catot ta có: ne = 2y + 0,06 = 0,3 => y = 0,12 mol
Từ (1) => x = 0,08 mol
=> [KCl] = 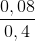 = 0,2M
= 0,2M
[CuCl2] = 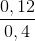 = 0,3M
= 0,3M
=> Đáp án D
Luyện tập
Câu hỏi liên quan
-





Cho sơ đồ phản ứng:
H2
 X
X  Y
Y  Z
Z  T
T  propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là


Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?


