Điện phân 2 lít dung dịch CuSO4 với điện cực trơ và dòng điện một chiều có cường độ I = 10A cho đến

Câu hỏi
Nhận biếtĐiện phân 2 lít dung dịch CuSO4 với điện cực trơ và dòng điện một chiều có cường độ I = 10A cho đến khi catot bắt đầu có khí thoát ra thì ngừng, thấy phải mất 32 phút 10 giây. Nồng độ mol CuSO4 ban đầu và pH dung dịch sau phản ứng là:
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
Điện phân dung dịch CuSO4 tới khi bắt đầu khí thoát ra thì ngừng nghĩa là Cu2+ đã bị điện phân hết.
Áp dụng định luật Faraday ta có:
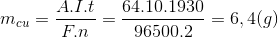
=> nCu = 0,1 mol
Phương trình điện phân: CuSO4 + H2O 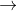 Cu + H2SO4 + 1/2 O2
Cu + H2SO4 + 1/2 O2
0,1 0,1 0,1
=> [CuSO4] = 0,1/2 = 0,05 M
Và: nH2SO4 = 0,1 => nH+ = 0,2 mol
=> [H+] = 0,2/2 = 0,1 M => pH = 1
=> Đáp án D
Luyện tập
Câu hỏi liên quan
-




Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?

Cho sơ đồ phản ứng:
H2
 X
X  Y
Y  Z
Z  T
T  propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là


