Có 4 chất X, Y, Z, T cùng công thức đơn gi

Câu hỏi
Nhận biếtCó 4 chất X, Y, Z, T cùng công thức đơn giản nhất. Khi đốt cháy mỗi chất đều cho số mol CO2 bằng số mol H2O và bằng số mol O2 tham gia phản ứng cháy. Phân tử khối mỗi chất đều nhỏ hơn 200 và chúng có quan hệ chuyển hoá theo sơ đồ sau:
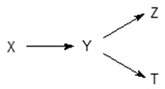
Y là chất nào trong số:
Đáp án đúng: D
Lời giải của Tự Học 365
Cách giải nhanh bài tập này
Vì nCO2 = nH2O = nO2 (phản ứng) = a ( mol)
BTNT "O": nO = 2nCO2 + nH2O – 2nO2 = 2a + a – 2a = a (mol)
=> C : H : O = nC : nH : nO = 1 : 2 : 1
CTĐGN: CH2O
Vì M < 200 => (CH2O)n < 200 => 30n < 200 => n < 6,67
Từ sơ đồ chuyển hóa ta thấy với các giá trị n = 1, 3, 6 thỏa mãn.
Sơ đồ:
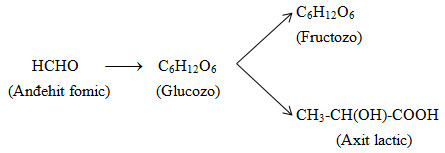
Đáp án D
Luyện tập
Câu hỏi liên quan
-

Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?








 X
X  Z
Z  T
T  propan-2-ol.
propan-2-ol.