Cho m gam bột Zn vào 500 ml dung dịch Fe2(SO4)3 024M. Sau khi các phản ứng xảy ra hoàn toàn khối lư

Câu hỏi
Nhận biếtCho m gam bột Zn vào 500 ml dung dịch Fe2(SO4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 9,6 gam so với khối lượng dung dịch ban đầu. Giá trị của m là
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
\(\begin{gathered}{n_{F{{\text{e}}_2}{{(S{O_4})}_3}}} = 0,24.0,5 = 0,12mol \hfill \\n{}_{F{{\text{e}}^{3 + }}} = 0,24 \hfill \\\end{gathered} \)
Zn + 2Fe3+ → Zn2+ + 2Fe2+
0,12….0,24…………….0,24
Zn + Fe2+ → Zn2+ + Fe
x……………………x
→ mdd tăng = mZn - mFe= 65(0,12 + x) – 56x = 9,6 → x = 0,2
=> nZn ban đầu = 0,12+ 0,2 = 0,23 mol => mZn = 0,32.65 =28,8 gam
Đáp án D
Luyện tập
Câu hỏi liên quan
-







Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?


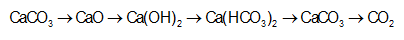
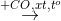 X
X 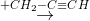 Z
Z 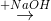 T
T  propan-2-ol.
propan-2-ol.