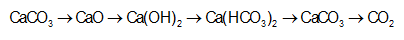Cho hệ cân bằng: N2 + 3H2 ↔ 2NH3 ( các chất đều ở trạng thái khí) khi tăng nhiệt độ thì tỉ khối của

Câu hỏi
Nhận biếtCho hệ cân bằng: N2 + 3H2 ↔ 2NH3 ( các chất đều ở trạng thái khí), khi tăng nhiệt độ thì tỉ khối của hỗn hợp giảm. Điều khẳng định nào sau đây đúng?
Đáp án đúng: B
Lời giải của Tự Học 365
Giải chi tiết:
Khi tăng nhiệt độ, tỉ khối của hỗn hợp giảm tức cân bằng chuyển dịch theo chiều nghịch là chiều phản ứng thu nhiệt, vậy chiều thuận là chiều phản ứng tỏa nhiệt.
=>B
Luyện tập
Câu hỏi liên quan
-




Cho sơ đồ phản ứng:
H2
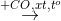 X
X 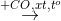 Y
Y  Z
Z 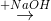 T
T 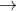 propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là



Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?