Cho 200 ml dung dịch X gồm Ba(OH)2 05M và NaAlO2 (hay Na[Al(OH)4]) 15M. Thêm từ từ dung dịch H2SO4 0
![Cho 200 ml dung dịch X gồm Ba(OH)2 05M và NaAlO2 (hay Na[Al(OH)4]) 15M. Thêm từ từ dung dịch H2SO4 0 Cho 200 ml dung dịch X gồm Ba(OH)2 05M và NaAlO2 (hay Na[Al(OH)4]) 15M. Thêm từ từ dung dịch H2SO4 0](https://tuhoc365.vn/wp-content/uploads/2020/03/qa-238x145.png)
Câu hỏi
Nhận biếtCho 200 ml dung dịch X gồm Ba(OH)2 0,5M và NaAlO2 (hay Na[Al(OH)4]) 1,5M. Thêm từ từ dung dịch H2SO4 0,5M vào X cho đến khi kết tủa tan trở lại một phần, thu được kết tủa Y. Đem nung Y đến khối lượng không đổi được 24,32 gam chất rắn Z. Thể tích dung dịch H2SO4 0,5M đã dùng là
Đáp án đúng: B
Lời giải của Tự Học 365
Giải chi tiết:
\({n_{O{H^ - }}} = 0,2(mol);\,\,\,\,\,\,{n_{Al{O_2}^ - }} = 0,3(mol);\,\,\,\,\,{n_{B{a^{2 + }}}} = 0,1(mol)\)
\({n_{{H^ + }}} = 2{\rm{x}}(mol) ;\,\,\,\,\,\,\,\,\,{n_{S{O_4}^{2 - }}} = x(mol)\)
Ba2+ + SO42- → BaSO4
OH- + H+ → H2O
AlO2- + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Nhận thấy BaSO4 đạt cực đại trước Al(OH)3 (vì khi x = 0,1 mol thì BaSO4 cực đại nhưng Al(OH)3 chưa cực đại)
→ Chất rắn sau nung phải chứa BaSO4 (lượng này cực đại) và Al2O3
Ta có: \({n_{BaS{O_4}}} = {n_{B{a^{2 + }}}} = 0,1(mol)\)
→ \({m_{A{l_2}{O_3}}} = 24,32 - 0,1.233 = 1,02(g) \to {n_{A{l_2}{O_3}}} = \frac{{1,02}}{{102}} = 0,01(mol)\)
→ \({n_{Al{{(OH)}_3}}} = 2{n_{A{l_2}{O_3}}} = 0,02(mol)\)
=> nH+ = nOH- + 4nAlO2 – 3nAl(OH)3 = 1,34 mol
=> Vdd H2SO4 = 1,34 lit
Đáp án B
Luyện tập
Câu hỏi liên quan
-


Cho sơ đồ phản ứng:
H2
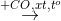 X
X 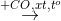 Y
Y 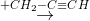 Z
Z  T
T 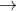 propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là




Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?