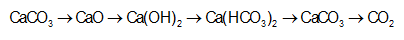Cho 200 ml dung dịch hỗn hợp gồm Ba(OH)2 01M và NaOH 01M phản ứng với x ml dung dịch H2SO4 005M thu

Câu hỏi
Nhận biếtCho 200 ml dung dịch hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M phản ứng với x ml dung dịch H2SO4 0,05M thu được (200 + x) ml dung dịch có pH = 13. Sau phản ứng, khối lượng kết tủa tối đa thu được là
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
nBa(OH)2 = 0,2.0,1 = 0,02 (mol)
nNaOH = 0,2. 0,1 = 0,02 (mol)
=> ∑nOH- = 2nBa(OH)2 + nNaOH = 0,06 (mol)
nH2SO4 = 5.10-5x (mol) => nH+ = 2nH2SO4 = 10-4x (mol)
Vì dd thu được có pH = 13 => dư bazo sau phản ứng
PT ion rút gọn:
H+ + OH- → H2O (1)
10-4x → 10-4x (mol)
Ba2+ + SO42- → BaSO4↓(2)
nOH- dư = nOH- bđ – nOH- (1) = 0,06 – 10-4x
pOH =14 -13 = 1 => [OH-] dư = 0,1 (M)
Ta có:
\(\eqalign{
& {{\rm{[O}}{{\rm{H}}^{\rm{ - }}}{\rm{]}}_{du}} = {{{n_{O{H^ - }du}}} \over {V{\,_{sau}}}} \Rightarrow 0,1 = {{0,06 - {{10}^{ - 4}}x} \over {(200 + x){{.10}^{ - 3}}}} \cr
& \Rightarrow 0,02 + {10^{ - 4}}x = 0,06 - {10^{ - 4}}x \cr
& \Rightarrow {2.10^{ - 4}}x = 0,04 \cr
& \Rightarrow x = 200\,(ml) \cr} \)
=> nH2SO4 = 0,01 (mol) => nSO42- = 0,01 (mol) < nBa2+ = 0,02 (mol)
=> mBaSO4 = 0,01.233 = 2,33 (g) (Tính theo mol SO42-)
Đáp án D
Luyện tập
Câu hỏi liên quan
-







Cho sơ đồ phản ứng:
H2
 X
X  Y
Y  Z
Z 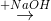 T
T 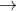 propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là