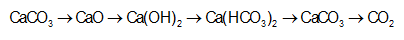Hỗn hợp X gồm metan propen và isopropen. Đốt cháy hoàn toàn 900 gam X cần vừa đủ 22176 lít O2 (đktc)

Câu hỏi
Nhận biếtHỗn hợp X gồm metan, propen và isopropen. Đốt cháy hoàn toàn 9,00 gam X cần vừa đủ 22,176 lít O2 (đktc). Mặt khác, a mol X phản ứng tối đa với 0,06 mol brom. Giá trị của a là
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
Ta thấy ( Về số C và H)
=> Quy đổi hỗn hợp về CH4: x (mol) và C5H8: y (mol) vẫn đảm bảo về số liên kết pi
Phản ứng đốt cháy:
CH4 + 2O2 \(\xrightarrow{{{t^0}}}\) CO2 + 2H2O
a → 2a (mol)
C5H8 + 7O2 \(\xrightarrow{{{t^0}}}\) 5CO2 + 4H2O
b → 7b (mol)
Giải hệ phương trình:
\(\left\{ \begin{gathered}
{m_X} = 16x + 68y = 9 \hfill \\
{n_{{O_2}}} = 2x + 7y = \frac{{22,176}}{{22,4}} = 0,99 \hfill \\
\end{gathered} \right. = > \left\{ \begin{gathered}
x = 0,18 \hfill \\
y = 0,09 \hfill \\
\end{gathered} \right.\)
Xét trong a mol X nC5H8 = ½ nBr2 = ½. 0,06 = 0,03 (mol)
=> a mol X có số mol CH4 là \(\frac{{0,03.0,18}}{{0,09}} = 0,06\,(mol)\)
=> a = nCH4 + nC5H8 = 0,06 + 0,03 = 0,09 (mol)
Đáp án D
Luyện tập
Câu hỏi liên quan
-






Cho sơ đồ phản ứng:
H2
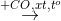 X
X 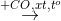 Y
Y 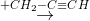 Z
Z 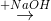 T
T 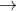 propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là

Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?