Trong bình kín chứa 35 ml hỗn hợp gồm H2, một amin đơn chức và 40 ml O

Câu hỏi
Nhận biếtTrong bình kín chứa 35 ml hỗn hợp gồm H2, một amin đơn chức và 40 ml O2. Bật tia lửa điện để đốt cháy hoàn toàn hỗn hợp, rồi đưa hỗn hợp thu được về điều kiện ban đầu. Thể tích các chất tạo thành bằng 20 ml gồm 50% là CO2, 25% là N2, 25% là O2. CTPT của amin là
Đáp án đúng: A
Lời giải của Tự Học 365
Giải chi tiết:
Do điều kiện như nhau nên ta sử dụng thể tích như số mol (để tiện tính toán)
Ta có: 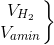 35 ml + 40 ml O2
35 ml + 40 ml O2 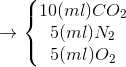
Amin đơn chức => V amin = 2 V N2 = 10 ml
=> V H2 = 35 - 10 = 25 ml
=> Số C của amin là: 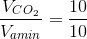 = 1
= 1
Trong các phương án đã cho chỉ có CH5N thỏa mãn
=> Đáp án A
Luyện tập
Câu hỏi liên quan
-


Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?






 X
X  Z
Z  T
T  propan-2-ol.
propan-2-ol.
