Hòa tan hết 2148 gam hỗn hợp X gồm Fe Mg và Fe(NO3)2 vào dung dịch chứa 042 mol H2SO4 loãng và 002 m

Câu hỏi
Nhận biếtHòa tan hết 21,48 gam hỗn hợp X gồm Fe, Mg và Fe(NO3)2 vào dung dịch chứa 0,42 mol H2SO4 loãng và 0,02 mol KNO3, thu được dung dịch Y (chất tan chỉ có 54,08 gam các muối trung hòa) và 3,74 gam hỗn hợp Z gồm ba khí không màu (trong đó hai khí có số mol bằng nhau). Dung dịch Y phản ứng được tối đa với 0,82 mol NaOH, thu được 26,57 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích của khí có phân tử khối lớn nhất trong Z là
Đáp án đúng: C
Lời giải của Tự Học 365
Giải chi tiết:
\(21,48(g)\left\{\begin{matrix}
Fe\\
M\\
Fe(NO_{3})_{2}
\end{matrix}\right.+\left\{\begin{matrix}
H_{2}SO_{4}:0,42\\
KNO_{3}:0,02
\end{matrix}\right.\rightarrow \left\{\begin{matrix}
H_{2}O\\
3,74(g)\left\{\begin{matrix}
TH1:H_{2},N_{2},NO\\
TH2:H_{2},N_{2},N_{2}O\\
TH3:H_{2},NO,N_{2}O
\end{matrix}\right.\\
ddY\left\{\begin{matrix}
Fe^{2+},Fe^{3+},Mg^{2+}:a(g)\\
NH_{4}^{+}:b(mol)\\
K^{+}\\
SO_{4}^{2-}
\end{matrix}\right.\overset{+NaOH:0,82(mol)}{\rightarrow}\left\{\begin{matrix}
26,57(g)↓\left\{\begin{matrix}
Fe(OH)_{2}\\
Fe(OH)_{3}\\
Mg(OH)_{2}
\end{matrix}\right.\\
dd\left\{\begin{matrix}
Na^{+}:0,82\\
K^{+}:0,02\\
SO_{4}^{2-}:0,42
\end{matrix}\right.
\end{matrix}\right.
\end{matrix}\right.\)
BTKL: mX + mH2SO4 + mKNO3 = mkhí + mmuối + mH2O
→ mH2O = 21,48 + 0,42.98 + 0,02.101 - 3,74 - 54,08 = 6,84 (g) → nH2O = 0,38 (mol)
Xét dd Y + NaOH sau phản ứng thu được dd chứa Na+: 0,82 (mol); K+: 0,02 (mol) và SO42-: 0,42 (mol)
Bảo toàn điện tích cho dd thu được sau pư thấy vừa đủ nên Y không còn NO3-
Đặt tổng khối lượng của Fe2+, Fe3+, Mg2+ = a(g)
Đặt số mol của NH4+ = b (mol)
→ nOH- trong kết tủa = 0,82 - b (mol)
Ta có hệ pt:
\(\left\{ \begin{array}{l}{m_Y} = a + 18b + 0,02.39 + 0,42.96 = 54,08\\{m_ \downarrow } = a + 17.(0,82 - b) = 26,57\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 12,8{\mkern 1mu} (g)\\b = 0,01{\mkern 1mu} (mol)\end{array} \right.\)
BTNT "H" ta có: 2nH2SO4 = 2nH2 + 4nNH4+ + 2nH2O → nH2 = (2.0,42-4.0,01 - 2.0,38)/2 = 0,02 (mol)
BTKL: mNO3-(X) = mX - (mFe2+,Fe3+, Mg2+) = 21,48 - 12,8 = 8,68 (g) → nNO3(X) = 0,14 (mol)
BTNT "N": nN(trong hh khí Z) = nNO3-(X) + nKNO3 - nNH4+ = 0,14 + 0,02 - 0,01 = 0,15 (mol)
BTKL: mZ = mH + mN + mO → mO(Z) = 3,74 - 0,02.2 - 0,15.14 = 1,6 (g) → nO(Z) = 0,1 (mol)
Z chứa H2 : 0,02 (mol) và hai trong 3 khí N2, NO, N2O
TH1: Z chứa H2: 0,02 (mol) và N2 và NO: 0,1 (mol)
nN(Z) = 0,15 (mol) → nN2 = 0,025 (mol) → Loại vì không có hai khí có cùng số mol
TH2: Z chứa H2: 0,02 (mol) và N2 và N2O: 0,1 (mol)
nN(Z) = 0,15 (mol) → nN2 âm → loại
TH3: Z chứa H2: 0,02 (mol) và NO: x (mol) và N2O: y (mol)
Ta có hệ: \(\left\{\begin{matrix}x+2y=0,1\\ x+y=0,1\end{matrix}\right.\Rightarrow x=y=0,05\)
\(\% {V_{{N_2}O}} = \frac{{0,05}}{{0,02 + 0,05 + 0,05}}.100\% = 41,67\% {\text{ }}\)
Đáp án C
Luyện tập
Câu hỏi liên quan
-







Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?


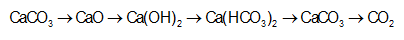
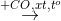 X
X 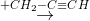 Z
Z  T
T 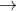 propan-2-ol.
propan-2-ol.