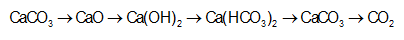Hòa tan a gam tinh thể CuSO4.5H2O vào

Câu hỏi
Nhận biếtHòa tan a gam tinh thể CuSO4.5H2O vào nước thu được dung dịch X. Điện phân dung dịch X với điện cực trơ và cường độ dòng điện là 1,93 (A). Nếu thời gian điện phân là t (s) thu được kim loại ở catod và 156,8 (ml) khí ở anod. Nếu thời gian điện phân là 2t (s) thì thu được 537,6 (ml) khí ở cả hai điện cực. Biết các khí đo ở đktc. Thời gian t và giá trị a lần lượt là
Đáp án đúng: A
Lời giải của Tự Học 365
Lời giải chi tiết:
Gọi n CuSO4 = x mol CuSO4 + H2O → Cu + H2SO4 + 1/2 O2 TH1 : n O2 = 0,007 mol => ne trao đổi = 4nO2 = 0,028 mol nên t = 1400s TH2: có thêm H2O tham gia điện phân H2O → H2 + 1/2 O2 y y mol nên ta có : n e trao đổi = 2x + 2y = 0,056 mol
Lại có nO2 = 0,25 n e trao đổi = 0,14 mol
=> nH2 = n khí – n O2 = y = 0,01 mol => x= 0,18 mol
=> a= 4,5 g
=> Đáp án A
Luyện tập
Câu hỏi liên quan
-




Cho sơ đồ phản ứng:
H2
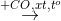 X
X 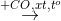 Y
Y 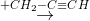 Z
Z 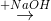 T
T 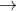 propan-2-ol.
propan-2-ol.Biết X, Y, Z, T đều là sản phẩm chính. Công thức cấu tạo thu gọn của X và Z lần lượt là


Xét hệ cân bằng hóa học sau xảy ra trong bình kín: C (rắn) + H2O (hơi) <-> CO (khí) + H2 (khí)
Tác động nào sau đây vào hệ (giữ nguyên các điều kiện khác) không làm chuyển dịch cân bằng?