Ôn đúng trọng tâm – Học chắc từ hôm nay
1. Chọn chất phù hợp, viết phương trình (ghi rõ điều kiện phản ứng)

Câu hỏi
Nhận biết(3 điểm)
1. Chọn chất phù hợp, viết phương trình (ghi rõ điều kiện phản ứng) thực hiện biến đổi sau về Nitơ và các hợp chất của nitơ :
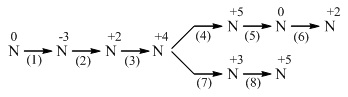
2. Hòa tan hoàn toàn 16,2 gam bột kim loại M hóa trị III vào 5 lít dung dịch HNO3 0,5M (d = 1,25g/ml). Sau khi phản ứng kết thúc thu được 2,8 lít (ở 0oC và 2 atm) hỗn hợp khí gồm NO, N2 . Trộn hỗn hợp khí này với lượng oxi vừa đủ thành hỗn hợp A, sau phản ứng thấy thể tích khí chỉ bằng 5/6 thể tích của hỗn hợp A.
Xác định nguyên tử khối và gọi tên kim loại M. Tính nồng độ % dung dịch HNO3 sau phản ứng.
Đáp án đúng:
Lời giải của Tự Học 365
Giải chi tiết:
1. Các phương trình phản ứng :
(1) N2 + 3H2  2NH3
2NH3
(2) 4NH3 + 5O2 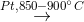 4NO + 6H2O
4NO + 6H2O
(3) 2NO + O2  2NO2
2NO2
(4) 4NO2 + O2 + 2H2O  4HNO3
4HNO3
(5) 5Mg + 12 HNO3 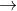 5Mg(NO3)2 + N2 + 6H2O
5Mg(NO3)2 + N2 + 6H2O
(6) N2 + O2  2NO
2NO
(7) 2NO2 + 2KOH 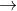 KNO2 + KNO3 + H2O
KNO2 + KNO3 + H2O
(8) 5KNO2 + 2KMnO4 + 3H2SO4 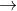 5KNO3 + K2SO4 + 2MnSO4 + 3H2O
5KNO3 + K2SO4 + 2MnSO4 + 3H2O
2. a/ Phương trình phản ứng:
M + 4HNO3 → M(NO3)3 + NO + 2H2O (1)
a 4a a
10M + 36HNO3 → 10M(NO3)3 + 3N2 + 18 H2O (2)
b 3,6b 0,3b
2NO + O2 → 2NO2
a 0,5a a
số mol M = a + b =  (I)
(I)
số mol hh (NO + N2) = a + 0,3b = 0,25 (II)
số mol hh A = a + 0,3b + 0,5a = 1,5a + 0,3b =  (a + 0,3b)
(a + 0,3b)
Suy ra 5a = b (III).
Giải hệ (I), (II), (III) ta được a = 0,1; b = 0,5 và M = 27 do đó M là Al
b/ Số mol HNO3 bđ = 5 .0,5 = 2,5
Số mol HNO3 pư = 4.0,1 + 3,6.0,5 = 2,2
Số mol HNO3 dư = 0,3 m HNO3 dư = 18,9 gam
khối lượng dung dịch sau pư = 5000 .1,25 + 16,2 –(28. 0,3. 0,5 + 30. 0,1)= 6259 g
Vậy C% HNO3 sau pư =  .100% = 0,3%
.100% = 0,3%

