1. Viết các phương trình phản ứng và ghi rõ điều kiện thực hiện sơ đồ
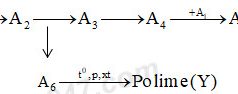
Câu hỏi
Nhận biết1. Viết các phương trình phản ứng và ghi rõ điều kiện thực hiện sơ đồ chuyển hóa sau:
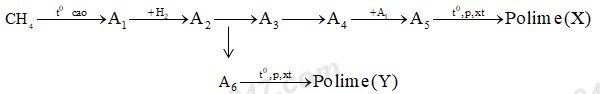
Cho biết từ A1 đến A6 là các chất hữu cơ khác nhau và mỗi mũi tên là một phản ứng.
2. Hỗn hợp khí A gồm C2H6, C3H6 và C4H6 tỉ khối của A so với H2 bằng 24. Đốt cháy hoàn toàn 0,96 gam A trong oxi dư rồi cho toàn bộ sản phẩm cháy vào 1 lít dung dịch Ba(OH)2 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa và dung dịch B. Hỏi khối lượng dung dịch B tăng hay giảm bao nhiêu gam so với dung dịch Ba(OH)2 ban đầu?
Đáp án đúng:
Lời giải của Tự Học 365
Giải chi tiết:
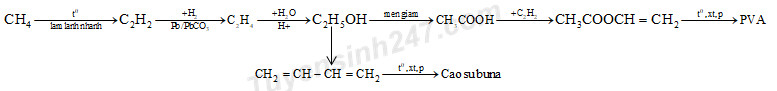
Phương trình hóa học:
\(\begin{gathered}
2C{H_4}\xrightarrow[{lam\,lanh\,nhanh}]{{{t^o}}}{C_2}{H_2} + 3{H_2} \hfill \\
{C_2}{H_2} + {H_2}\xrightarrow[{}]{{Pd/PbC{O_3}}}{C_2}{H_4} \hfill \\
{C_2}{H_4} + {H_2}O\xrightarrow[{}]{{{H^ + }}}{C_2}{H_5}OH \hfill \\
{C_2}{H_5}OH + {O_2}\xrightarrow{{men\,giam}}C{H_3}COOH + {H_2}O \hfill \\
C{H_3}COOH + {C_2}{H_2}\xrightarrow{{HgS{O_4},{H_2}S{O_4},{{80}^o}C}}C{H_3}COOCH = C{H_2} \hfill \\
nC{H_3}COOCH = C{H_2}\xrightarrow{{{t^o},xt,p}}{( - C{H_2} - CH - )_n} \hfill \\
\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,| \hfill \\
\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,C{H_3}COO \hfill \\
2{C_2}{H_5}OH\xrightarrow{{A{l_2}{O_3},{{450}^o}C}}C{H_2} = CH - CH = C{H_2} + {H_2} + 2{H_2}O \hfill \\
nC{H_2} = CH - CH = C{H_2}\xrightarrow{{{t^o},xt,p}}{( - C{H_2} - CH = CH - C{H_2} - )_n} \hfill \\
\end{gathered} \)
2.
Gọi công thức chung bình của A là CxH6
MA = 24.2 = 48 => 12x + 6 = 48 => x = 3,5. Công thức trung bình của A là C3,5H6
Số mol của A: \({n_A} = \frac{{{m_A}}}{{{M_A}}} = \frac{{0,96}}{{48}} = 0,02(mol)\)
Đốt cháy A:
\(\begin{gathered}
{C_{3,5}}{H_6} + 5{O_2}\xrightarrow{{{t^o}}}3,5C{O_2} + 3{H_2}O \hfill \\
0,02\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,0,07\, \to 0,06\,\,\,\,(mol) \hfill \\
\end{gathered} \)
Ta có: \(1 < \frac{{{n_{C{O_2}}}}}{{{n_{Ba{{(OH)}_2}}}}} = \frac{{0,07}}{{0,05}} = 1,4 < 2\)
=> Khi cho CO2 vào Ba(OH)2 tạo ra 2 muối, cả CO2 và Ba(OH)2 đều phản ứng hết.
CO2 + Ba(OH)2 → Ba(HCO3)2 (1)
2x x x (mol)
CO2 + Ba(OH)2 → BaCO3 + H2O (2)
y y y (mol)
Gọi số mol của Ba(OH)2 ở phương trình (1) và (2) lần lượt là x, y (mol)
+ nBa(OH)2 = 0,05 mol => x + y = 0,05 (*)
+ nCO2 = 0,07 mol => 2x + y = 0,07 (**)
Từ (*) và (**) ta có hệ phương trình:
\(\left\{ \begin{gathered}
2x + y = 0,07 \hfill \\
x + y = 0,05 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
x = 0,02 \hfill \\
y = 0,03 \hfill \\
\end{gathered} \right.\)
Độ biến thiên khối lượng dung dịch: Δm = mCO2 + mH2O – mBaCO3 = 0,07.44 + 0,06.18 – 0,03.197 = -1,75 (g)
Vậy khối lượng dung dịch giảm so với khối lượng dung dịch ban đầu là 1,75 gam.

