Độ pH của một dung dịch được tính theo công thức pH = - log [ H^ + ] với [ H^ + ] là nồng độ ion
![Độ pH của một dung dịch được tính theo công thức pH = - log [ H^ + ] với [ H^ + ] là nồng độ ion Độ pH của một dung dịch được tính theo công thức pH = - log [ H^ + ] với [ H^ + ] là nồng độ ion](https://tuhoc365.vn/wp-content/uploads/2020/03/qa-238x145.png)
Câu hỏi
Nhận biếtĐộ pH của một dung dịch được tính theo công thức \(pH = - \log \left[ {{H^ + }} \right]\) với \(\left[ {{H^ + }} \right]\) là nồng độ ion \({H^ + }\) trong dung dịch đó. Cho dung dịch A có độ pH ban đầu bằng \(6.\) Nếu nồng độ ion \({H^ + }\) trong dung dịch A tăng lên 4 lần thì độ pH trong dung dịch mới gần bằng giá trị nào dưới đây?
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
Khi độ \(pH = 6\) ta có \(6 = - \log \left[ {{H^ + }} \right] \Leftrightarrow \left[ {{H^ + }} \right] = {10^{ - 6}}\)
Khi nồng độ ion \(\left[ {{H^ + }} \right]\) tăng 4 lần tức là lúc này \(\left[ {{H^ + }} \right] = {4.10^{ - 6}}\) thì độ pH là
\(pH = - \log \left[ {{H^ + }} \right] = - \log \left( {{{4.10}^{ - 6}}} \right) \approx 5,4\).
Chọn D.
Luyện tập
Câu hỏi liên quan
-





Trong không gian với hệ trục Oxyz, cho mặt phẳng (P): 2x + y + 2z + 4 = 0, đường thẳng d:
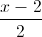 =
= 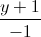 =
= 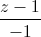 và đường thẳng ∆ là giao tuyến của hai mặt phẳng x = 1, y + z - 4 = 0. Viết phương trình mặt cầu có tâm thuộc d, đồng thời tiếp xúc với ∆ và (P) biết rằng tâm của mặt cầu có tọa độ nguyên.
và đường thẳng ∆ là giao tuyến của hai mặt phẳng x = 1, y + z - 4 = 0. Viết phương trình mặt cầu có tâm thuộc d, đồng thời tiếp xúc với ∆ và (P) biết rằng tâm của mặt cầu có tọa độ nguyên.


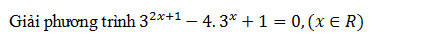
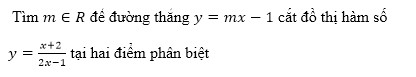
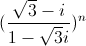 là số thực và z2 =
là số thực và z2 = 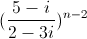 là số ảo.
là số ảo.