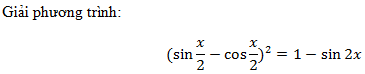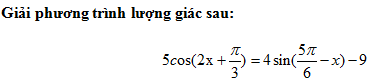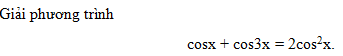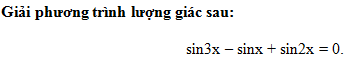Trộn 100ml dung dịch HCl 0,1M với V ml dung dịch Ba(OH)

Câu hỏi
Nhận biếtTrộn 100ml dung dịch HCl 0,1M với V ml dung dịch Ba(OH)2 0,1M, sau phản ứng thu được dung dịch có pH = 12,7. Giá trị của V là:
Đáp án đúng: B
Lời giải của Tự Học 365
Cách giải nhanh bài tập này
nH+ = nHCl = 0,01 mol; nOH- = 2nBa(OH)2 = 0,2V mol
pHsau = 12,7 > 7 => OH- dư => pOH = 14 - 12,7 = 1,3 => [OH-] = 10-1,3
H+ + OH- → H2O
Bđ: 0,01 0,2V
Pư: 0,01 → 0,01
Sau: 0 0,2V - 0,01
\(\left[ {O{H^ - }} \right] = \frac{{{n_{O{H^ - }}}}}{V} \to {10^{ - 1,3}} = \frac{{0,2V - 0,01}}{{0,1 + V}}\) => V = 0,1 lít
Đáp án B