Đốt cháy 124 gam phốt pho trong bình chứa 17 gam oxi tạo ra điphotpho pentaoxit (P2O5) là chất rắn m

Câu hỏi
Nhận biếtĐốt cháy 12,4 gam phốt pho trong bình chứa 17 gam oxi tạo ra điphotpho pentaoxit (P2O5) là chất rắn, màu trắng.
a/ photpho hay oxi chất nào còn dư và số mol dư là bao nhiêu
b/ chất nào được tạo thành? khối lượng là bao nhiêu.
Đáp án đúng: B
Lời giải của Tự Học 365
Giải chi tiết:
\({n_P} = {{12,4} \over {31}} = 0,4\,mol\); \({n_{O2}} = {{17} \over {32}} = 0,53125\left( {{\rm{ }}mol} \right)\)
PTPƯ: 4P + 5O2  2P2O5 (1)
2P2O5 (1)
Theo PT 4 5 (mol)
Theo ĐB 0,4 0,53125
Ta thấy \(\frac{{0,4}}{4} < \frac{{0,53125}}{5}\) => P phản ứng hết, O2 dư. Mọi tính toán theo số mol của P
a/ Theo (1): \({n_{{O_{2(P}}_{u)}}} = {5 \over 4}{n_p} = {5 \over 4} \times 0,4 = 0,5\,mol\)
=> nO2(DƯ) = 0,53125 – 0,5= 0,03125(mol)
b/ Sản phẩm tạo thành là P2O5
theo (1): \({n_{{P_2}{O_5}}} = {1 \over 2}{n_P} = {1 \over 2}\,.\,0,4 = 0,2\,mol\)
=> mP2O5 = 0,2 . ( 31 . 2 + 16 . 5) = 28,4 (g)
Đáp án B
Luyện tập
Câu hỏi liên quan
-

Có 4 ống nghiệm cùng thể tích, mỗi ống đựng một trong bốn khí sau (không theo thứ tự): O2, H2S, SO2, và HCl. Lật úp từng ống nghiệm và nhúng vào các chậu nước thì kết quả thu được như các hình vẽ dưới đây:
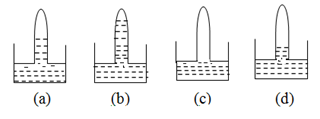
Vậy các bình a, b, c, và d lần lượt chứa các khí



Trong phòng thí nghiệm, điều chế các chất khí K,L,M,N,G theo sơ đồ sau:
Cu + H2SO4 đặc → K ↑+ ....
FeS + HCl
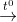 L ↑ +....
L ↑ +....H2O2
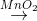 M↑ +....
M↑ +....CaC2 + H2O → N ↑ + ....
Al4C3 + H2O → G ↑ + ...
Số chất khí có thể làm mất màu nước brom là





