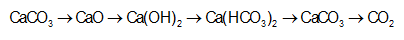Cho 10 lít hỗn hợp khí N2 và CO2 (đktc) đi qua 2 lít dung dịch Ca(OH)2 002M thu được 1g kết tủa. Xác

Câu hỏi
Nhận biếtCho 10 lít hỗn hợp khí N2 và CO2 (đktc) đi qua 2 lít dung dịch Ca(OH)2 0,02M thu được 1g kết tủa. Xác định thành phần % theo thể tích của CO2 trong hỗn hợp.
Đáp án đúng: D
Lời giải của Tự Học 365
Giải chi tiết:
Số mol Ca(OH)2 = 2.0,02 = 0,04 mol
Số mol Ca(OH)2 = 2.0,02 = 0,04 mol
Số mol CaCO3 = 1_100=0,01 mol
Bài toán này có thể là 1 trong 2 trường hợp sau:
TH1: Số mol CO2 không đủ tác dụng với số mol Ca(OH)2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Số mol CO2 = số mol CaCO3 =0,01 mol
=>Thể tích CO2 = 22,4.0,01=0,224 lít
Vậy %thể tích CO2 = (0,224.100)/10=2,24%
TH2: Số mol CO2 nhiều hơn số mol Ca(OH)2 tham gia phản ứng:
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (2)
Theo (1): số mol CO2 (1) = số mol CaCO3 = Số mol Ca(OH)2 = 0,04 mol
Ta có: Số mol CaCO3 (2) = 0,04-0,01 = 0,03 (mol)
Theo (2): Số mol CO2(2) = số mol CaCO3 (2) = 0,03 (mol)
Vậy tổng số mol CO2 phản ứng (1) và (2) là 0,04 + 0,03 = 0,07 mol
Do đó %thể tích CO2 = (0,07.22,4.100)/10 = 15,68%
Luyện tập
Câu hỏi liên quan
-


Có 4 ống nghiệm cùng thể tích, mỗi ống đựng một trong bốn khí sau (không theo thứ tự): O2, H2S, SO2, và HCl. Lật úp từng ống nghiệm và nhúng vào các chậu nước thì kết quả thu được như các hình vẽ dưới đây:
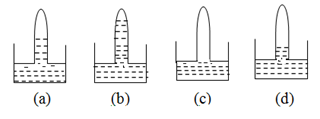
Vậy các bình a, b, c, và d lần lượt chứa các khí



Trong phòng thí nghiệm, điều chế các chất khí K,L,M,N,G theo sơ đồ sau:
Cu + H2SO4 đặc → K ↑+ ....
FeS + HCl
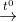 L ↑ +....
L ↑ +....H2O2
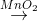 M↑ +....
M↑ +....CaC2 + H2O → N ↑ + ....
Al4C3 + H2O → G ↑ + ...
Số chất khí có thể làm mất màu nước brom là