Amin – Tính chất vật lý tính chất hóa học điều chế amin

Amin – Tính chất vật lý, tính chất hóa học, điều chế amin
I - Tính chất vật lí của amin
– Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
– Anilin là chất lỏng, nhiệt độ sôi là 184oC, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen.
II – Cấu tạo phân tử amin
- Trong phân tử amin đều có nguyên tử nitơ còn một cặp electron tự do chưa liên kết có thể tạo cho – nhận giống NH3 ⇒ Vì vậy các amin có tính bazơ giống NH3 (tức tính bazơ của amin = tính bazơ của NH3).
$R-\ddot{N}{{H}_{2}}$
III - Tính chất hoá học của amin:
a) Amin có tính Bazơ:
| – Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do kết hợp với proton mạnh hơn amoniac.
CH3NH2 + HOH → CH3NH3+ + OH– Metylamin Metyl amino hiđroxit – Amin bậc III mà gốc hiđrocacbon R, R’ và R’’ có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận proton H+ ⇒ tính bazơ yếu ⇒ dung dịch không làm đổi màu quỳ tím và phenolphtalein. – Anilin và các amin thơm rất ít tan trong nước. Dung dịch của chúng không làm đổi màu quỳ tím và phenolphtalein. |
Δ Amin Tác dụng với axit :
Tổng quát : R–NH2 + HCl → R–NH3Cl
Ví dụ : CH3NH2 + HCl → CH3NH3Cl
C6H5NH2 + HCl → (C6H5NH3)+Cl–
phenylamoni clorua
Δ Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa :
Ví dụ : 3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
◊ Lưu ý : Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) → hiđroxit kết tủa → kết tủa tan (tạo phức chất).
b) Phản ứng với axit nitrơ HNO2 :
– Amin các bậc khác nhau tác dụng với axit nitrơ theo những cách khác nhau, nhờ đó có thể phân biệt các bậc amin.
Δ Amin béo bậc I :
Tổng quát : R–NH2 + HO–NO $\xrightarrow{HCl}$ R–OH + N2↑ + H2O
Ví dụ : C2H5NH2 + HONO → C2H5OH + N2↑ + H2O
Δ Amin thơm bậc I : Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 – 5oC) cho muối điazoni.
Ví dụ :
C6H5NH2 + HONO + HCl $\xrightarrow{0-{{5}^{0}}C}$ C6H5N2+Cl– + 2H2O
Anilin (NaNO2/HCl) benzenđiazoni clorua
Δ Amin bậc II :
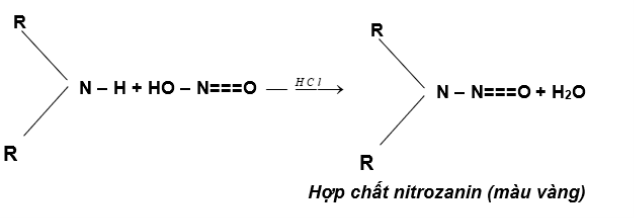
Ví dụ : (CH3)2–NH + HONO → (CH3)2N–N=O + H2O
(màu vàng)
![]() C6H5–NH–CH3 + HONO → C6H5–N–CH3 + H2O
C6H5–NH–CH3 + HONO → C6H5–N–CH3 + H2O
N=O
Δ Amin béo bậc III :
→ không còn hiđro liên kết với nitơ nên không phản ứng với axit nitrơ.
Ví dụ : (CH3)3N + HONO → không tác dụng
c) Phản ứng ankyl hóa amin:
– Amin bậc I hoặc bậc II tác dụng với ankyl halogenua (CH3I, …)
– Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
Ví dụ : C2H5NH2 + CH3I → C2H5NHCH3 + HI
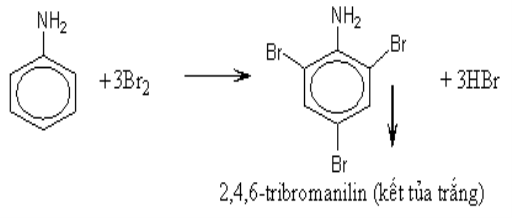
d) Phản ứng thế ở nhân thơm của anilin :
– Tương tự như phenol, anilin tác dụng với nước brom tạo thành kết tủa trắng 2,4,6–tribrom Anilin.
– Các muối amoni tác dụng dễ dàng với kiềm :
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O
(Ít tan trong nước)
e) Phản ứng cháy của amin no đơn chức mạch hở :
Tổng quát : ${{C}_{n}}{{H}_{2n+3}}N+\frac{6n+3}{4}{{O}_{2}}\xrightarrow{{{t}^{0}}}nC{{O}_{2}}+\frac{2n+3}{2}{{H}_{2}}O+\frac{1}{2}{{N}_{2}}$
Ví dụ: ${{C}_{2}}{{H}_{7}}N+\frac{15}{4}{{O}_{2}}\xrightarrow{{{t}^{0}}}2C{{O}_{2}}+\frac{7}{2}{{H}_{2}}O+\frac{1}{2}{{N}_{2}}$
IV. ĐIỀU CHẾ AMIN
1. Khử hợp chất nitro tạo amin :
Ar–NO2 + 6[H] $\xrightarrow{F\text{e}/HCl}$ Ar–NH2 + 2H2O
Ví dụ : C6H5NO2 + 3Fe + 6HCl → C6H5NH2 + 3FeCl2 + 2H2O
◊ Đặc biệt điều chế anilin :
C6H6 $\xrightarrow[{{H}_{2}}S{{O}_{4}}\ dac]{HN{{O}_{3}}\ dac}$ C6H5NO2 $\xrightarrow{F\text{e}/HCl}$ C6H5NH2
2. Từ amoniac với dẫn xuất halogen hoặc rượu tương ứng :
RX + NH3 $\xrightarrow[{{C}_{2}}{{H}_{5}}OH]{{{100}^{0}}C}$ RNH2 + HX
◊ Với các tỉ lệ mol khác nhau, có thể cho amin bậc I, II, III hoặc IV :
RX $\xrightarrow{+N{{H}_{3}}}$ R–NH2 $\xrightarrow[+N{{H}_{3}}]{R\text{X}}$ R–NH–R $\xrightarrow[+N{{H}_{3}}]{R\text{X}}$ (R)3N $\xrightarrow{R\text{X}}$ [(R)4N]+X–
3. Từ hợp chất nitril :
R–C≡N + 4[H] $\xrightarrow[{{C}_{2}}{{H}_{5}}OH]{Na}$ R–CH2–NH2
HÓA HỌC LỚP 12
