Hòa tan 3,38 gam oleum X vào lượng nước dư ta thu được dung dịch A. Để

Câu hỏi
Nhận biếtHòa tan 3,38 gam oleum X vào lượng nước dư ta thu được dung dịch A. Để trung hòa 1/20 lượng dung dịch A cần dùng 40 ml dung dịch NaOH 0,1M. Tìm công thức của oleum.
Đáp án đúng: A
Lời giải của Tự Học 365
Giải chi tiết:
Gọi công thức của oleum là H2SO4.nSO3.
Số mol của oleum trong 3,38 gam là a mol.
nNaOH = 0,04. 0,1 = 0,004 mol
Các PTHH:
PTHH: H2SO4.nSO3 + nH2O → (n + 1) H2SO4.
Mol a mol → (n +1) a
H2SO4 + 2NaOH → Na2SO4 + 2H2O
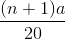 → 2.
→ 2. 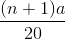
=> nNaOH = 2 . 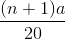 = 0,004 => (n +1 )a = 0,04 (I)
= 0,004 => (n +1 )a = 0,04 (I)
(II) (98 + 80n)a = 3,38
Từ (I) và (II) suy ra:
a = 0,01
n = 3
CTPT của oleum là : H2SO4.3SO3
Luyện tập
Câu hỏi liên quan
-







Trong phòng thí nghiệm, điều chế các chất khí K,L,M,N,G theo sơ đồ sau:
Cu + H2SO4 đặc → K ↑+ ....
FeS + HCl
 L ↑ +....
L ↑ +....H2O2
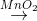 M↑ +....
M↑ +....CaC2 + H2O → N ↑ + ....
Al4C3 + H2O → G ↑ + ...
Số chất khí có thể làm mất màu nước brom là

Có 4 ống nghiệm cùng thể tích, mỗi ống đựng một trong bốn khí sau (không theo thứ tự): O2, H2S, SO2, và HCl. Lật úp từng ống nghiệm và nhúng vào các chậu nước thì kết quả thu được như các hình vẽ dưới đây:
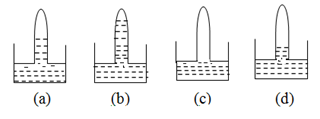
Vậy các bình a, b, c, và d lần lượt chứa các khí


