Cho một bình kín dung tích không đổi chứa 80ml nước và 4 lít không khí (xem hình vẽ). Phần không khí

Câu hỏi
Nhận biếtCho một bình kín dung tích không đổi chứa 80ml nước và 4 lít không khí (xem hình vẽ). Phần không khí chỉ chứa N2 và O2 theo tỷ lệ 4:1 về thể tích. Bơm 0,04 mol hỗn hợp khí B bao gồm NO2 và NO có tỷ khối so với H2 bằng 19 vào bình và lắc kỹ bình tới khi các phản ứng sau xảy ra hoàn toàn:
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
Ta được dung dịch X. Tính nồng độ % dung dịch X
Giả sử áp suất hơi nước trong bình không đáng kể; các thể tích khí đều đo ở đktc; khối lượng riêng của nước = 1g/ml
Đáp án đúng: C
Lời giải của Tự Học 365
Giải chi tiết:
nhh B = 0,896 : 22,4 = 0,04 mol và 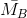 = 19.2 = 38
= 19.2 = 38
Sơ đồ đường chéo:

=> = 1 =>
= 1 => 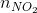 = nNO = 0,02 mol
= nNO = 0,02 mol
Các PTHH xảy ra khi bơm khí B vào nước:
2NO + O2 → 2NO2 (1)
4NO2 + O2 + 2H2O → 4HNO3 (2)
Số mol NO2(1) = nNO = 0,02 mol
Số mol NO2(2) = Số mol NO2(1) + Số mol NO2 = 0,02 + 0,02 = 0,04 mol
Số mol O2 ban đầu =  = 0,336 mol >
= 0,336 mol > 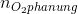 = 0,03 mol
= 0,03 mol
=>Số mol HNO3 = 0,04 mol
mdd = mnước ban đầu +  - mnước (2) = 80 + 0,04.63 – 0,02. 18 = 82,16 gam
- mnước (2) = 80 + 0,04.63 – 0,02. 18 = 82,16 gam
C% (HNO3) = 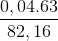 .100% = 3,07%
.100% = 3,07%
Luyện tập
Câu hỏi liên quan
-

Có 4 ống nghiệm cùng thể tích, mỗi ống đựng một trong bốn khí sau (không theo thứ tự): O2, H2S, SO2, và HCl. Lật úp từng ống nghiệm và nhúng vào các chậu nước thì kết quả thu được như các hình vẽ dưới đây:
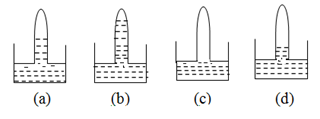
Vậy các bình a, b, c, và d lần lượt chứa các khí




Trong phòng thí nghiệm, điều chế các chất khí K,L,M,N,G theo sơ đồ sau:
Cu + H2SO4 đặc → K ↑+ ....
FeS + HCl
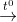 L ↑ +....
L ↑ +....H2O2
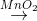 M↑ +....
M↑ +....CaC2 + H2O → N ↑ + ....
Al4C3 + H2O → G ↑ + ...
Số chất khí có thể làm mất màu nước brom là





