Một hỗn hợp A gồm 2 hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. CTPT X, Y và khối lượng của X, Y là:
Phương pháp giải
+) nCO2 = nH2O = 1,3 mol => Gọi công thức của 2 hiđrocacbon là: \({C_{\overline n }}{H_{2\overline n }}\)
+) \(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,3}}{{0,5}} = 2,6\)
+) Gọi số mol C2H4 và C3H6 là a, b (mol)
+) Ta có 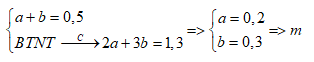
Lời giải của Tự Học 365
nCO2 = nH2O = 1,3 mol => Gọi công thức của 2 hiđrocacbon là: \({C_{\overline n }}{H_{2\overline n }}\)
\(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,3}}{{0,5}} = 2,6\) => CTPT của 2 chất là C2H4 và C3H6
Gọi số mol C2H4 và C3H6 là a, b (mol)
Ta có:
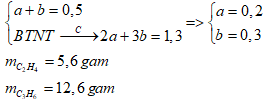
Đáp án cần chọn là: c
Hóa Lớp 12
