Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc, nóng, dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Cho từ từ dung dịch NaOH 1M đến dư vào Y thu được kết quả như hình vẽ sau:
Khối lượng Cr2O3 trong hỗn hợp ban đầu là
Phương pháp giải
+) Tại điểm khối lượng kết tủa không đổi => chỉ có Fe(OH)3
+) Tính nHNO3 pư
Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng
BT e: \(3{{n}_{Al~}}=2{{n}_{S{{O}_{2}}}}~=>{{n}_{Al}}~\)
Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng
Tính số mol Cr2O3 theo PTHH
Lời giải của Tự Học 365
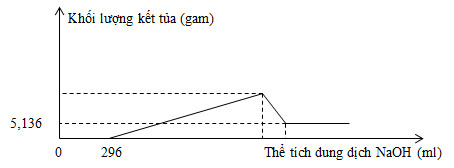
Quan sát đồ thị ta thấy:
\({{m}_{Fe{{\left( OH \right)}_{3}}}}=5,136\text{ }gam\Rightarrow {{n}_{Fe{{\left( OH \right)}_{3}}}}=0,048\text{ }mol\)
nHNO3 dư = 0,296 mol => nHNO3 pư = 0,8 – 0,296 = 0,504 mol
Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng
BT e: \(3{{n}_{Al~}}=2{{n}_{S{{O}_{2}}}}~=>{{n}_{Al}}~=2.\frac{0,09}{3}=0,06\text{ }mol\)
Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
0,06→0,24
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
0,024 ← 0,144 ← 0,048
Cr2O3 + 6HNO3 → 2Cr(NO3)3 + 3H2O
0,02 ← 0,12
\({{m}_{C{{r}_{2}}{{O}_{3}}}}\)(1 phần) = 0,02.152 = 3,04 gam
=> \({{\mathbf{m}}_{\mathbf{C}{{\mathbf{r}}_{\mathbf{2}}}{{\mathbf{O}}_{\mathbf{3}}}}}~=\mathbf{6},\mathbf{08}\text{ }\mathbf{gam}\)
Đáp án cần chọn là: c
Hóa Lớp 12
