Điện phân (với điện cực trơ, cường độ dòng điện không đổi) dung dịch muối nitrat của một kim loại M (có hóa trị không đổi). Sau thời gian t giây, khối lượng dung dịch giảm 6,96 gam và tại catot chỉ thu được (a) gam kim loại M. Sau thời gian 2t giây, khối lượng dung dịch giảm 11,78 gam và tại catot thoát ra 0,224 lít khí (đktc). Giá trị của (a) là
Phương pháp giải
Giải theo phương pháp đặt ẩn phụ
Đặt hóa trị của kim loại M hóa trị x . Đặt \({x \over M}\)= k
Trong t giây số mol e trao đổi ta: ne trao đổi = \(x.{a \over M}\) = ka => nO2 = ka/4
Khối lượng dd giảm = mM + mO2 là 6,96 gam → a + 32ka/4 = 6,96 (1)
Trong 2t giây thì số mol e trao đổi ở mối điện cực là 2ka
→ Khối lượng dd giảm = mM + mH2 + mO2
\( \to {{2ka - 0,02} \over x}.M + 0,01.2 + 0,5ka.32 = 11,78\,(2)\)
biến đổi rút gọn nhất biểu thức (1) và (2), sau đó thế (1) vào (2) ta sẽ ra được k
Từ đó tìm được x, M và a
Lời giải của Tự Học 365
Đặt hóa trị của kim loại M hóa trị x . Đặt \({x \over M}\) = k
Trong t giây quá trình xảy ra tại các điện cực
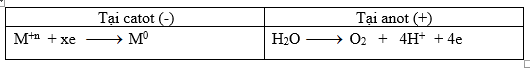
Số mol e trao đổi ta: ne trao đổi = \(x.{a \over M}\) = ka => nO2 = ka/4
Khối lượng dd giảm là 6,96 gam
→ a + 32ka/4 = 6,96
→ a + 8ka = 6,96 (1)
Trong 2t giây thì số mol e trao đổi ở mối điện cực là 2ka
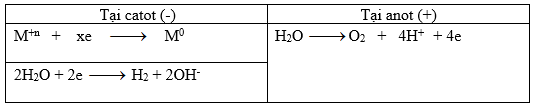
Tại catot: nH2 = 0,01 => nM = (2ka – 0,02)/x
Tại anot: nO2 = 2ka/4 = 0,5ka (mol)
→ Khối lượng dd giảm = mM + mH2 + mO2
\(\eqalign{
& \to {{2ka - 0,02} \over x}.M + 0,01.2 + 0,5ka.32 = 11,78 \cr
& \to {{2ka - 0,02} \over k} + 16ka = 11,76 \cr
& \to a - {{0,01} \over k} + 8ka = 5,88(2) \cr} \)
Thế (1) vào (2) \(6,96 - {{0,01} \over k} = 5,88 \to k = {1 \over {108}}\)
Ta có:\(k = {x \over M} \to {x \over M} = {1 \over {108}}\)
→ Chọn x = 1 và M = 108 (Ag) thỏa mãn
Thế \(k = {1 \over {108}}\) vào (1) →\(a + 8.{1 \over {108}}a = 6,96 \to a = 6,48\,(g)\)
Đáp án cần chọn là: c
Hóa Lớp 12
