Một cốc đựng muối cacbonat của một kim loại hóa trị 2. Rót từ từ dung dịch H2SO4 có nồng độ 20% vào

Câu hỏi
Nhận biếtMột cốc đựng muối cacbonat của một kim loại hóa trị 2. Rót từ từ dung dịch H2SO4 có nồng độ 20% vào cốc cho đến khi khí thoát ra vừa hết thì thu được dung dịch muối có nồng độ 24,91%. Hãy xác định muối cacbonat của kim loại gì?
Đáp án đúng: B
Lời giải của Tự Học 365
Giải chi tiết:
Phương trình phản ứng hóa học:
MCO3 + H2SO4 → MSO4 + H2O + CO2↑
Giả sử có 1 mol H2SO4 (hay 98g) tham gia phản ứng hóa học thì khối lượng dung dịch H2SO4 20% sẽ là:
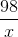 .100= 20 =>x = 490 (g)
.100= 20 =>x = 490 (g)
Khối lượng H2O trong 490 gam dung dịch axit là: 490 – 98 = 392 (g)
Theo phương trình: Có 1 mol muối tạo ra thì cũng có 1 mol nước và cũng có 1 mol CO2 bay ra ngoài.
Vậy khối lượng dung dịch thu được bao gồm:
1 mol MSO4 +1 mol H2O + 392g H2O cũ = (M+96)g + 18g +392g = M + 506g
Ta có phương trình:
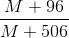 .100 = 24,91
.100 = 24,91
=>100M + 9600 = 24,91M + 12604,46
Giải ra M ≈ 40 là khối lượng nguyên tử của canxi và hợp chất đó là CaCO3
