Hỗn hợp A gồm C2H2 và H2. Cho 1008 lít A đi qua ống đựng chất xúc tác Niddun nóng thu được 6944 lít

Câu hỏi
Nhận biếtHỗn hợp A gồm C2H2 và H2. Cho 10,08 lít A đi qua ống đựng chất xúc tác Niddun nóng, thu được 6,944 lít hỗn hợp khí B gồm 4 chất. Dẫn B đi chậm qua bình đựng nước brom dư cho phản ứng xảy ra hoàn toàn, thu được 4,48 lít hỗn hợp khí C. Biết rằng 1 mol A có khối lượng 10 gam và các thể tích khí đều đo ở điều kiện tiêu chuẩn
Hãy viết các phương trình phản ứng xảy ra và tính thành phần phần trăm theo thể tích của các khí trong hỗn hợp A, B, C
Đáp án đúng: A
Lời giải của Tự Học 365
Giải chi tiết:
Phương trình phản ứng:
C2H2 + H2 → C2H4 (1)
C2H2 + 2H2 → C2H6 (2)
- Hỗn hợp khí B gồm: C2H4, C2H6, C2H2, dư và H2 dư. Dẫn B qua nước brom dư thì C2H4 và C2H2 bị giữ lại bình
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
nA = 10,08/22,4 = 0,45 mol
- Đặt số mol các chất trong A là: C2H2 x mol, H2 y mol
Ta có hệ phương trình:
x + y = 0,45 (3)
(26x + 2y) : 0,45 = 10 (4)
Giải ta được: x = 0,15, y = 0,3
Thành phần % các chất trong A:
%C2H2 = 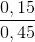 .100% = 33,33%
.100% = 33,33%
%H2 = 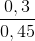 .100% = 66,67%
.100% = 66,67%
nB = 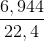 = 0,31 mol
= 0,31 mol
Số mol H2 tham gia phản ứng = Độ giảm số mol khí = 0,45 – 0,31 =0,14 mol
Số mol H2 dư = 0,3 – 0,14 = 0,16 mol
nC = 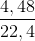 = 0,2 mol
= 0,2 mol
nC2H6 = 0,2 – 0,16 = 0,04 mol
Thành phần % các chất trong C:
%C2H6 = 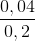 .100% = 20%
.100% = 20%
%H2 = 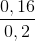 .100% = 80%
.100% = 80%
- Theo phản ứng (1) và (2):
(2) nC2H2 = nC2H6 = 0,04 mol; nH2 = 0,04.2 = 0,08 mol
(1) nH2 = 0,14 – 0,08 = 0,06 mol => nC2H4 = 0,06 mol; nC2H2 = 0,06 mol
Số mol C2H2 phản ứng = 0,04 + 0,06 = 0,1 mol
Số mol C2H2 dư = 0,15 – 0,1 = 0,05 mol
- Thành phần % các chất trong B:
%C2H4 = 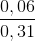 .100% = 19,35%
.100% = 19,35%
%C2H6 = 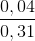 .100% = 12,9%
.100% = 12,9%
%C2H2 = 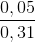 .100% = 16,13%
.100% = 16,13%
%H2 = 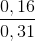 .100% = 51,61%
.100% = 51,61%
=> Đáp án A
