. (1,5 điểm) 4.1. Cho 26,91 gam kim loại kiềm M (hóa trị I) vào 700

Câu hỏi
Nhận biếtCâu 4(VD). (1,5 điểm)
4.1. Cho 26,91 gam kim loại kiềm M (hóa trị I) vào 700 ml dung dịch AlCl3 0,5M, sau khi phản ứng xảy ra hoàn toàn thu được V lít khí H2 (đktc) và 17,94 gam kết tủa. Tìm kim loại M và các giá trị có thể có của V.
4.2. Có hai dung dịch: Dung dịch A chứa H2SO4 85%, dung dịch B chứa HNO3 chưa biết nồng đô. Hỏi phải trộn hai dung dịch này theo tỷ lệ khối lượng là bao nhiêu để dược một dung dịch mới, trong đó H2SO4 có nồng độ 60%, HNO3 có nồng độ 20 %. Tính nồng độ phần trăm của dung dịch HNO3 ban đầu (biết khi trộn A với B không có phản ứng xảy ra).
Đáp án đúng:
Lời giải của Tự Học 365
Giải chi tiết:
4.1
Ta có : nAlCl3 = 0,7.0,5 = 0,35 mol > nAl(OH)3 = 0,23 mol
( Kim loại kiềm hòa vào dung dịch AlCl3 tạo kiềm và phản ứng với AlCl3 tạo kết tủa Al(OH)3)
+) TH1 : AlCl3 dư, kiềm hết
M + H2O 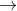 MOH + ½ H2
MOH + ½ H2
3MOH + AlCl3 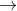 3MCl + Al(OH)3
3MCl + Al(OH)3
=> nM = nMOH = nAl(OH)3 = 0,23 mol
=> MM = 117g (Cadimi không phải là kim loại kiềm => Loại)
+) TH2 : Al(OH)3 bị hòa tan 1 phần
M + H2O 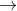 MOH + ½ H2
MOH + ½ H2
Mol x 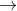 x
x 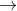 ½ x
½ x
3MOH + AlCl3 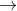 3MCl + Al(OH)3
3MCl + Al(OH)3
Mol 3y ¬ y 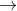 y
y
Al(OH)3 + MOH 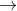 MAlO2 + 2H2O
MAlO2 + 2H2O
Mol (x – 3y) ¬ (x – 3y)
=> nAl(OH)3 = y – (x – 3y) = 0,23 mol
Và nAlCl3 = y = 0,35 mol => x = 1,17 mol
=> MM = 23g => Na
=> VH2 = 22,4.0,5.0,23 = 2,576 lit
4.2
Gọi x là C% của dung dịch HNO3
m1, m2 lần lượt là khối lượng dung dịch H2SO4 85% và dung dịch HNO3 x%
a) m H2SO4 = 0,85m1
C% H2SO4 =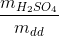 .100= 60 <=>
.100= 60 <=> 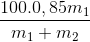 = 60
= 60
=>25m1 = 60m2
=> m1 : m2 = 60 : 25 = 12 : 5
b) m HNO3 =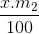 = 0,01.m2
= 0,01.m2
=> .100 = 20 => x = 68
Vậy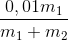 C% HNO3 = 68%
C% HNO3 = 68%
