Ôn đúng trọng tâm – Học chắc từ hôm nay
Hệ thống lại kiến thức lớp 10–11–12
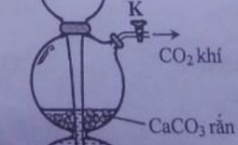
: 1. Trong thí nghiệm , người ta dùng bình kíp để điều chế CO2 như hì
Câu hỏi
Nhận biết(2,0 điểm):
1. Trong thí nghiệm , người ta dùng bình kíp để điều chế CO2 như hình bên.
a. Khí CO2 thu được thường bị lẫn với khí HCl và hơi nước. Hãy trình bày phương pháp hóa học để thu được CO2 tinh khiết, Viết phương trình minh họa.
b.Giải thích tại sao muốn phản ứng ngừng lại hoặc tái diễn , chỉ cần đóng hoặc mở khóa K.

2. Hòa tan hết 25,65g hỗn hợp X gồm Na,Ca,Na2O,CaO vào nước thu được 2,8 lit H2 (dktc) và dung dịch Y. Khối lượng NaOH có trongY là 14g. Hấp thụ hoàn toàn 16,8 lit CO2(dktc) vào dung dịch Y thu được m gam kết tủa.
a. Tính số mol Ca(OH)2 có trong Y.
b. Tìm m.
Đáp án đúng:
Lời giải của Tự Học 365
Giải chi tiết:
1.
a.
+) Cho hỗn hợp khí đi qua bình đựng Ca(OH)2 dư. Lọc lấy kết tủa.
Ca(OH)2 + CO2 -> CaCO3↓ + H2O
Ca(OH)2 + 2HCl -> CaCl2 + 2H2O
+) Cho kết tủa vào dung dịch H2SO4 đặc thì chỉ có CO2 thoát ra, hơi nước sẽ bị axit đặc giữ lại.
Ta thu được CO2 tinh khiết
CaCO3 + H2SO4 -> CaSO4 + CO2↑ + H2O
b.
Vì Bình đựng CaCO3 và bình đựng HCl bên dưới thông với nhau.
Khi CO2 quá nhiều làm áp suất bình đựng CaCO3 tăng lên => tạo áp lực đẩy HCl xuống bình dưới không cho tiếp xúc với CaCO3 nữa =< phản ứng ngừng lại.
Còn khi mở khóa K => CO2 tràn ra ngoài => áp suất trong bình CaCO3 giảm => tạo lực hút ngược HCl từ dưới lên tiếp xúc với CaCO3 => phản ứng tái diễn.
2.
a.
Na + H2O -> NaOH + ½ H2
Ca + 2H2O -> Ca(OH)2 + H2
Nếu Đốt cháy X hoàn toàn tạo hỗn hợp Z toàn oxit thì :
2Na + ½ O2 -> Na2O
Ca + ½ O2 -> CaO
=> nO = nH2 = 0,125 mol
Vậy mZ = mX + mO pứ = 27,65g ( Z gồm Na2O và CaO)
Số mol nguyên tố Na và Ca đều không đổi trong X và Z => cùng tạo ra số mol bazo như nhau
Nếu Z + H2O tạo dung dịch Y => nNaOH = 0,35 mol => nNa2O = 0,175 mol
=> nCaO = nCa(OH)2 = 0,3 mol => nOH = 0,95 mol
b.
Khi hấp thụ nCO2 = 0,75 mol do nOH : 1 < nCO2 = 1,27 < 2 => phản ứng tạo 2 muối.
OH- + CO2 -> HCO3-
, x --- x ---- x mol
2OH- + CO2 -> CO32- + H2O
, 2y ---- y ----- y mol
=> Hệ : x + 2y = 0,95 và x + y = 0,75 mol
=> x = 0,55 ; y = 0,2 mol
=> m = mCaCO3 = 100.0,2 = 20g

