Kim loại tác dụng với phi kim (cách giải bài tập có đáp án)

Kim loại tác dụng với phi kim (cách giải bài tập có đáp án)
Δ Một số vấn đề cần lưu ý trong bài toán kim loại tác dụng với S.
♦ Khi cho kim loại tác dụng với S, ta có dạng tổng quát như sau:
$M+S\xrightarrow{{{t}^{o}}}CR$ (M hóa trị 2)
.♦ Bài toán thường là phản ứng không hoàn toàn nên chất rắn thu được bao gồm $\left\{ \begin{array} {} MS \\ {} M \\ {} S \\ \end{array} \right.$
♦ Chất rắn thu được khi cho tác dụng với dung dịch axit loãng dư thì khí thu được bao gồm $\left\{ \begin{array} {} {{H}_{2}}S \\ {} {{H}_{2}} \\ \end{array} \right.$
Δ Phương pháp giải dạng kim loại tác dụng với phi kim
- Sử dụng định luật bảo toàn electron
- Sử dụng định luật bảo toàn khối lượng…
Δ Bài tập kim loại tác dụng với phi kim có đáp án
| Câu 1. Hỗn hợp X (gồm m1 gam bột Fe và m2 gam bột S trộn đều) đem nung ở nhiệt độ cao không có mặt oxi thu được hỗn hợp Y. Hòa tan Y bằng dung dịch HCl dư thu được 0,8 gam chất rắn A, dung dịch B và khí D (có tỉ khối so với H2 bằng 9). Dẫn khí D lội từ từ qua dung dịch CuCl2 dư thấy tạo thành 9,6 gam kết tủa. Tính m1 và m2. |
Lời giải chi tiết
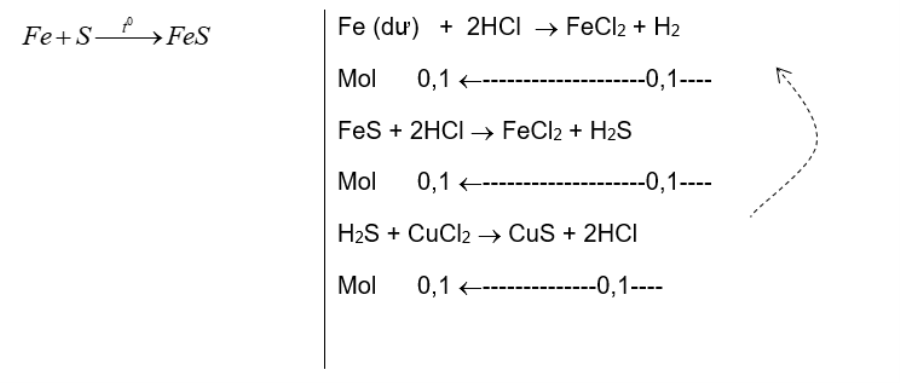
$d{}^{D}/{}_{{{H}_{2}}}=9\to \overline{{{M}_{D}}}=9.2=18\to \begin{matrix} {{H}_{2}}S\left( {{M}_{{{H}_{2}}S}}=34 \right) \\ {} \\ {{H}_{2}}\left( {{M}_{{{H}_{2}}}}=2 \right) \\\end{matrix}\ \ \begin{matrix} \backslash \\ \overline{{{M}_{D}}} \\ / \\\end{matrix}=18\begin{matrix} \nearrow \\ {} \\ \searrow \\\end{matrix}\begin{matrix} 18-2 \\ {} \\ {} \\ 34-18 \\\end{matrix}=\frac{16}{16}=\frac{1}{1}$
Ta có các phương trình hóa học ${{n}_{{{H}_{2}}S}}=0,{{1}^{mol}}\to {{n}_{{{H}_{2}}}}=0,{{1}^{mol}}$
nFe (dư) = 0,1 mol, nFeS = 0,1mol → nFe = nS = 0,1mol
m1 = mFe = mFe (dư) + mFe (dư) = 0,1.56 + 0,1.56 = 11,2 (gam)
m2 = mS = mS(pứ) + mS(dư) = 0,1.32 + 0,8 = 4,0 (gam)
| Câu 2: Cho 7,6 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 4,48 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 19,85 gam chất rắn Z chỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 7,6 gam X là
A. 2,4 gam. B. 1,8 gam. C. 4,6 gam. D. 3,6 gam. |
Lời giải chi tiết
♦ Gọi x, y lần lượt là số mol của Cl2 và O2 lần lượt là x và y
♦ Theo bài ra ta có
♦ Theo định luật bảo toàn khối lượng ta có : 71.x + 32.y = 19,85-7,6=12,25 (2)
Giải hệ (1)(2) ta được x = 0,15 (mol) ; y = 0,05 (mol)
♦ Gọi a và b lần lượt là số mol của Mg và Ca. Khi đó ta có 24.a + 40.b = 7,6 (3)
♦ Quá trình nhường nhận electron như sau :

Bảo toàn electron ta được: 2a +2b = 0,5 (4)
Giải hệ (3);(4) ta được a= 0,15 (mol); b= 0,1 (mol)
$\Rightarrow {{m}_{Mg}}=24.0,15=3,6\left( gam \right)$
Đáp án A
HÓA HỌC LỚP 12
