Một hỗn hợp X gồm 2 hiđrocacbon liên tiếp nhau trong dãy đồng đẳng. Đốt cháy hoàn toàn 0,5 mol hỗn hợp X thu được 29,12 lít khí CO2 (đktc) và 23,4 gam H2O. Công thức phân tử và thành phần % khối lượng tương ứng của hai hiđrocacbon là
Phương pháp giải
+) nCO2 = nH2O = 1,3 mol => Gọi công thức của 2 hiđrocacbon là:
\({C_{\overline n }}{H_{2\overline n }}\)
+) \(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,3}}{{0,5}} = 2,6\)
+) Gọi số mol C2H4 và C3H6 là a, b (mol)
+) Ta có: 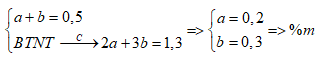
Lời giải của Tự Học 365
nCO2 = nH2O = 1,3 mol => Gọi công thức của 2 hiđrocacbon là:
\({C_{\overline n }}{H_{2\overline n }}\)
\(\overline n = \dfrac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \dfrac{{1,3}}{{0,5}} = 2,6\)=> CTPT của 2 chất là C2H4 và C3H6
Gọi số mol C2H4 và C3H6 là a, b (mol)
Ta có: 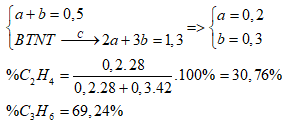
Đáp án cần chọn là: c
Hóa Lớp 12
