Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12),

Câu hỏi
Nhận biếtDãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là (Mg (Z=12), S (Z=16), Cl (Z=17), F (Z=9)).
Đáp án đúng: A
Lời giải của Tự Học 365
Giải chi tiết:
- Cấu hình e và vị trí của các nguyên tố:
12Mg: 1s22s22p63s2=> Chu kì 3, nhóm IIA
16S: 1s22s22p63s23p4 => Chu kì 3, nhóm VIA
17Cl: 1s22s22p63s23p5 => Chu kì 3, nhóm VIIA
9F: 1s22s22p5 => Chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tử các nguyên tố trong bảng tuần hoàn:
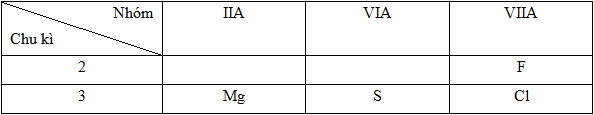
* Sự biến đổi bán kính trong bảng tuần hoàn:
- Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần
Như vậy bán kính nguyên tử các nguyên tố được sắp xếp như sau: Mg > S > Cl > F
Đáp án A
Luyện tập
Câu hỏi liên quan
-



Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit biến đổi như thế nào?


Một nguyên tố ở chu kì 3, nhóm VIA trong bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố đó là:


Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có ?

