Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu d

Câu hỏi
Nhận biếtCho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
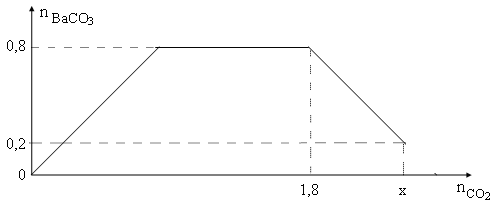
Tổng nồng độ phần trăm khối lượng của các chất tan trong dung dịch sau phản ứng là
Đáp án đúng: C
Lời giải của Tự Học 365
Giải chi tiết:
CO2 + Ba(OH)2 → BaCO3↓+ H2O (1)
CO2 + KOH → KHCO3 (2)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (tan) (3)
Số mol Ba(OH)2 ban đầu = 0,8 mol.
Tại nCO2= 1,8 mol: xảy ra cả PT (1) và (2): nCO2= nBa(OH)2+ nKOH= 1,8 mol→ nKOH= 1,0 mol
Số mol BaCO3 = 0,2 mol →khối lượng BaCO3 = 197.0,2 = 39,4 gam.
Số mol Ba(HCO3)2 = 0,6 mol → khối lượng Ba(HCO3)2 = 259.0,6 = 155,4 gam.
Số mol KOH = 1,0 mol = số mol KHCO3 →khối lượng KHCO3 = 100.1 = 100 gam.
Số mol CO2 = 2,4 mol→khối lượng CO2 = 44.2,4 = 105,6 gam.
Tổng khối lượng chất tan = 155,4 + 100 = 255,4 gam.
Khối lượng dung dịch sau phản ứng = 500 + 105,6 - 39,4 = 566,2 gam.
Tổng nồng độ phần trăm khối lượng chất tan \( = \frac{{255,4}}{{566,2}}.100\% = 45,11\% \)
Đáp án C
