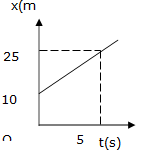Đốt cháy hoàn toàn 4,8 gam lưu huỳnh rồi cho sản phẩm cháy h

Câu hỏi
Nhận biếtĐốt cháy hoàn toàn 4,8 gam lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch Ba(OH)2 0,5M. Khối lượng kết tủa thu được là:
Đáp án đúng: A
Lời giải của Tự Học 365
Cách giải nhanh bài tập này
nS = 4,8/32= 0,15 (mol)
nBa(OH)2 = 0,2 . 0,5 = 0,1 (mol)
S + O2 → SO2
Theo PTHH: nSO2 = nS = 0,15 (mol)
Ta có tỉ lệ: 1 < nSO2 /nBa(OH)2 = 0,15/0,1 = 1,5 < 2
=> Thu được 2 muối: BaSO3 và Ba(HSO3)2
SO2 + Ba(OH)2 → BaSO3 + H2O
x → x → x (mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
2y → y → y (mol)
Ta có hệ phương trình gồm: nSO2 = x + 2y = 0,15 (1) và nBa(OH)2 = x+y = 0,1 (2)
Giải hệ phương trình => nBaSO3 = x = 0,05 (mol)
Vậy khối lượng kết tủa = mBaSO3 = 0,05.217 = 10,85 (gam)
Đáp án A
Luyện tập
Câu hỏi liên quan
-


Tìm mệnh đề trong các câu sau và cho biết chúng đúng hay sai?
a) 5 là số chẵn
b) Nếu AB2 + AC2 = BC2 thì tam giác ABC vuông.
c) 2 có phải là số nguyên tố không?
d) Hôm nay trời không mưa, chúng ta đi xem ca nhạc nhé!
e) Nếu phương trình bậc hai có \(\Delta \geq 0\) thì nó có nghiệm.
f) Trái đất quay quanh Mặt trời.
g) Tháng hai (dương lịch) có 30 ngày.
h) \(\pi^2 >10.\)
i) Tổng ba góc trong một tam giác bằng 1800.
j) Hình lập phương có 8 đỉnh.
k) Bao giờ chúng ta đi du lịch?
l) Thủy ngân không phải là kim loại.

Phương trình của một vật chuyển động thẳng có dạng: x = -3t + 4 (m; s). Kết luận nào sau đây đúng

Nêu mệnh đề phủ định của các mệnh đề sau và cho biết mệnh đề phủ định đúng hay sai?
A = “Mọi số thực đều là số nguyên”
B = “Tồn tại một số góc α sao cho sinα > 1”
C = “Mọi tam giác đều luôn là tam giác cân”.

Cho mệnh đề chứa biến P(x): “x = x4”. Xác định tính đúng – sai của các mệnh đề sau:
a) P(0) b) P(1) c) P(2)
d)P(-1) e)
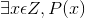 f) .
f) .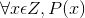

Phương trình chuyển động của một chất điểm dọc theo trục Ox có dạng : x = 5 + 60t (x : m, t đo bằng giờ).Chất điểm đó xuất phát từ điểm nào và chuyển động với vận tốc bằng bao nhiêu ?

Trên hình là đồ thị tọa độ-thời gian của một vật chuyển động
thẳng.
Cho biết kết luận nào sau đây là sai?

Nêu mệnh đề phủ định của các mệnh đề sau:
a) Tất cả các chất khí đều không dẫn điện.
b) Nhà toán học Cô – si (Cauchy) là người Ý.
c) 9081 là số chính phương.
d) Giải thưởng cao nhất về toán học trên thế giới là giải Nobel.
e) Có vô số số nguyên tố.
f) Một năm có tối đa 52 ngày chủ nhật.

Xét hai mệnh đề sau: P: “120 chia hết cho 6 và chia hết cho 8”
Q: “120 chia hết cho 6.8”
a) Phát biểu mệnh đề P => Q và cho biết mệnh đề này đúng hay sai.
b) Phát biểu mệnh đề P <=> Q và cho biết mệnh đề này đúng hay sai.

Một vật chuyển động thẳng đều với vận tốc v = 2 m/ s. Và lúc t = 2 s thì vật có toạ độ x = 5 m. Phương trình toạ độ của vật là